新研究证明熬夜可诱发癌症!

文/MarvinP 分子生物学博士 凤凰网《CC情报局》特约撰稿员
核心提要:
1.今年2月底,美国贝勒医学院和加州大学伯克利分校的科学家在《肝脏病学杂志》上发表了一篇关于熬夜致癌的研究,提供了“熬夜致癌”的直接证据。该研究发现昼夜紊乱会加速肝癌的生成和转移,甚至影响到肝癌细胞恶化和肿瘤的免疫抑制。
2.2007年,国际癌症研究机构(IARC)将“倒班引起的节律失调”划归为2A级致癌因素,这类因素至今在人体中的致癌性证据有限,但从近年来发表的多种动物试验获得的致癌性证据充分,不可掉以轻心。节律失调这一生活方式,致癌性与农药DDT和神经毒素丙烯酰胺相当。
3.近日南加州大学的研究者在肝脏中找到了节律基因,并将其命名为HNF4A,肝癌的特征之一正是HNF4A蛋白的低水平表达。节律失调也与乳腺癌有关,一项芬兰的研究显示,女性空服人员患上乳腺癌的几率较常人更高。升高的患癌几率与睡眠周期不稳定,以及在夜间接受光照有着强相关。
4.利用节律对细胞代谢水平的影响,可找到癌症病人最佳的给药时间,从而提高药效。时间疗法这个治疗概念,就利用新陈代谢和功能酶的节律性,给患者定时光照和补充褪黑素,以调整紊乱的节律,辅助治疗季节性疾病。

世卫为何将“熬夜”致癌性定义为2A级?加州大学的一项联合研究证明:熬夜确实会诱发肝癌
熬夜被公认为是伤害身体最严重的行为。 2007年,世界卫生组织将“熬夜”的致癌性定义为2A级,但一直没有确切的证据证实。
今年2月底,美国贝勒医学院和加州大学伯克利分校的科学家联合在最新一期《肝脏病学杂志》(Journal of Hepatology)发表了一篇关于“熬夜致癌原因”的研究,首次通过实验证实,黑白颠倒(慢性昼夜节律失调)确实是一种人类致癌物,确切地说,熬夜会直接诱发肝癌!
这项试验的具体机理是:昼夜紊乱能够直接重新编程NASH(人类非酒精性脂肪性肝炎)和HCC(肝细胞癌代谢、炎症和血管生成等)的基因转录组,进而加速肝癌的生成和转移,最后甚至影响到肝癌细胞恶化和肿瘤的免疫抑制。
在熬夜伤肝方面,中西医似乎殊途同归!
昼夜节律是生物内建的周期调控机制,将生理功能与可预见的环境变化相匹配,达到优化资源和保障安全的目的。人们天黑想睡觉,天亮醒来想吃早点,白天里体温、反应速度、身体协调性和警觉性都较高,到了夜晚则体温下降、血压上升、分泌褪黑素,这种以日为单位循环的生理活动就是生物节律,也称“生物钟”。英文的“节律(circadian)”一词就源自拉丁文的“大约(circa)”和“一日(dian)”。
当我们身体内部这个“时钟”失调时,癌症等很多疾病随之而来。
研究团队利用与人类生理节律相似的小白鼠进行实验后发现:肿瘤在黑白颠倒(慢性昼夜节律紊乱)的情况下自发发展,当把小鼠恢复到正常的昼夜节律时,其肿瘤发展减缓,并抑制了肿瘤转移,其基因表达模式恢复到以前的状态。
去年发表在美国科学期刊《Cell(细胞)》刊登的研究发现,熬夜缺觉除了致癌外,还会增加脑内前列腺素D2产生和经血脑屏障的外流,并容易诱发致命炎症风暴。
另一项于去年7月,由同济医院的研究团队在知名期刊《Cancer(癌症)》上发布的一项关于睡眠习惯、时间与癌症风险的研究称,对近1.5万人的分析发现,睡眠时间过短与癌症风险升高密切相关。
文章提示的三种风险分别为:睡眠<6小时的人,患癌风险升高41%;从来不午睡的人,患癌风险明显升高;晚上睡眠短还不午睡的人,患癌风险高。
熬夜竟如此伤人,昼夜节律为何对人类如此重要?倒班引起的节律失调为何会致癌?如何看待这些研究?
谁是控制我们生物钟的“上帝之手”?
早在2007年,国际癌症研究机构(IARC)就将“倒班引起的节律失调”划归为2A级致癌因素,但证明这类因素在人体中致癌的证据始终有限,然而近年来从发表的多种动物试验获得的致癌性证据充分,不可对其掉以轻心。节律失调这一生活方式,致癌性竟然与农药DDT和神经毒素丙烯酰胺相当!
昼夜节律,也叫“生物钟”,是我们大脑中24小时的内部时钟,通过与地球的昼夜周期同步,调节睡眠、清醒和几乎所有身体功能的周期。公元前四世纪,人们已经发现罗望子树的树叶会出现节律变化。1729年,法国科学家Jean-Jacques d'Ortous de Mairan首次记载了含羞草叶的昼夜节律周期,它们白天向太阳展开,晚上闭合,即使将含羞草移到无光照的屋中,叶片也会按时开合。更多研究显示,节律广泛存在于各类生物中,不光动植物,连微生物和细胞都展现出节律现象。1977年,相关机构将生物节律定义为“周期是24小时正负4小时的生理变化或节奏,该节奏可以与当地环境同步,也可以不受外界影响,但能保持约24小时的稳定周期”。
科学家认为,节律可能是生物配合地球自转周期的演化结果。在远古生命初诞之际,生态食物链的基底是依靠光合作用来获得能量的微小生物,所以它们需要在有日照时开启生长繁殖的生理功能,日落后关闭不需要的功能来节约能量。
乌飞兔走有定时,那些节律跟地球自转同步的生物能更好地配合环境,在日出前就做好准备来最大程度地利用阳光,日出后保存能源以备不时之需,因此比那些没有节律或者节律周期很诡异的生物更有演化优势。
处于食物链上层的动物虽然能量来源不直接受昼夜光照周期的限制,但夜晚黑且凉,为了安全和省能,许多生物会选择在夜晚歇息,白天找食。亿万年演化下来,节律也成为地球现存生物中的普遍特征,让大大小小的碳基生物们日出而作,日落而息。
为什么生物在没有外来刺激的情况下也能维持节律周期?内事问基因,节律也不例外,科学家已经对节律的分子机制有了一定了解。
1971年,加州理工大学的遗传学家Seymore Benzer博士和Ron Konopka博士在果蝇中发现了节律与基因的关系。果蝇有24小时的节律周期,即使处于黑暗环境中也能维持。研究者在果蝇中诱发了基因变异,发现有些果蝇出现节律紊乱。他们分析了这些果蝇的基因组后,找到一个基因,它的变异能影响生物昼夜节律,研究者将其命名为per(意为“period”,周期)。后来,研究者又在包括人类在内的多种生物中找到了这类节律基因。
Konopka博士继续钻研,在1984年,他和Jeffrey C. Hall博士以及Michael Rosbash博士带领的研究组又有了重要发现:per这个基因编码的蛋白质PER在细胞核内的浓度呈24小时的周期性起伏,白天降低,夜晚升高。原来,PER蛋白对per基因有负向调控效果,也即是说,per基因越活跃,制造的PER蛋白越多,刹车信号就越强烈,导致其活跃性降低,减少蛋白合成,这样又等于逐步放开刹车,让per基因开始再次活跃,周而复始。这种负反馈调控是节律基因的核心机制之一。

另一名遗传学家Michael W. Young博士的研究组发现,上述负反馈作用还需要另一种节律基因Timeless的帮助。 该基因产生的蛋白质TIM能与PER蛋白结合,协助其进入细胞核来阻止per基因的表达。 而TIM蛋白在光照刺激下会大量降解失活。 于是,TIM蛋白浓度在白天较低,PER缺乏帮助,无法阻止per基因转录,造成PER蛋白在细胞内积累,高浓度的节律基因蛋白让生物逐渐产生睡意。 到了夜晚,TIM蛋白浓度升高,协助PER蛋白进入细胞核调节per基因,让PER蛋白的浓度下降,睡意渐消,到早晨清醒,晨光将周期推入下一轮循环。这种精细的调控机制,让蛋白质表达出现周期性振荡,与之相关的生理功能也展现出节律性。
为了表彰他们所做出的贡献,评选委员会将2017年的诺贝尔生理或医学奖授予给Hall、Rosbash和Young这三位科学家,嘉奖他们发现了控制生物节律的分子机制。


睡眠周期混乱:空姐护士记者患乳腺癌几率高
迄今为止,科学家已经发现至少有15个基因与节律调节有关,它们精雕细琢,将节律周期控制在24小时左右。这些基因的功能包括让环境光照重置生物钟,控制糖代谢以及脂肪代谢周期等。

动物实验显示,破坏某些节律基因的功能,会导致动物进食周期失调,对胰岛素特别敏感、体重降低,而且倒起时差特别快,只需要一两天而不是一周,因此有潜力作为调节节律的靶点(以及非法基因编辑减肥的方案),但破坏另一些节律基因,却可能令动物暴食和肥胖,并影响其血糖代谢和脂肪利用效率,甚至患上糖尿病(非法减肥需谨慎)。
脑、心脏和肝脏的活动、激素制造、细胞再生和其他生理功能都与节律周期相关,如果器官之间的生物钟不同步,可能会产生健康问题。以肝脏为例,肝脏中的生物钟控制着储存和释放能量的功能,它需要与大脑的进食信号以及脂肪细胞的代谢控制同步。如果在非常规时间进食,比如半夜去撸串,可能会让身体贮存营养的功能失调,长期如此可能会导致肥胖和糖尿病。

比肥胖更可怕的是癌症。研究者发现,节律失常可能与前列腺癌、子宫内膜癌、结直肠癌、肺癌、卵巢癌和肝癌的发生风险以及不良预后有关。
还是以肝脏为例。近日南加州大学的研究者在肝脏中找到了节律基因,这个名为HNF4A的蛋白不光能调控肝细胞的功能基因表达,还是节律的核心之一,在各组织节律同步中有重要作用。它的表达水平具有时钟振荡性,会随着入夜升高。如果糟糕的睡眠习惯让人总是辗转反侧,该基因到了该加劲儿表达的时候却水平不足,调控的蛋白也因此失调,就可能引发癌症。研究显示,肝癌的特征之一正是HNF4A蛋白的低水平表达。熬夜伤肝,似乎这么说也没错。而今年二月发表的关于熬夜致癌的原因研究文章,也证实了肝脏最有可能致癌的证据。
也有较多研究显示节律失调跟乳腺癌有关,数据主要来自于夜班较多的工人和空服人员。节律失调可能促进乳腺上皮细胞增生,诱发乳腺发育,提高自发性乳腺癌生成的几率。一项芬兰的研究显示,女性空服人员患上乳腺癌的几率较高,每10万人有81.2名,相较之下普罗大众则是每10万名中有57.4名。后续研究显示,升高的患癌几率与睡眠周期不稳定,以及在夜间接受光照有着强相关。

另一项美国的研究显示,接受夜间光照最多的护士群体患乳腺癌的几率比接受夜光最少群体的几率高14%。分子生物学研究发现,节律基因PER2失调会影响雌激素受体(ER)的信号调控通路。在正常乳腺上皮细胞中,ER和PER2基因的表达都呈节律振荡,而ER阳性的乳腺癌细胞中PER2的表达不再有节律振荡。抑制PER2会让ER蛋白稳定,促进细胞生长,而细胞失控生长正是癌症发生的前期步骤之一。过量表达PER2则能抑制细胞生长,引发细胞凋亡。这些研究显示,功能正常的节律基因可能有抑癌作用。
除了乳腺癌,动物实验显示,反复经受时差煎熬的小鼠会出现节律基因失调,促进格拉斯高骨肉瘤生长,并有更高的几率发展出淋巴瘤和肝细胞癌。研究者采用技术手段让小鼠的相关节律基因失活,也验证了这个结果。


时间疗法:利用生物钟找到癌症病人最佳给药时间
值得一提的是,节律和疾病之间关系的许多结果是在动物或细胞系中获得,或者是流行病学的分析,距离直接的临床应用还有一段距离。不过,癌症治疗已经将多条与节律基因及其调控对象相关的信号途径作为靶点在研究。
另外还有研究者试图将其和临床治疗结合起来,试图找到最适合给药的时间:如果节律会影响细胞代谢水平,那么可否利用这一点来提高药效呢?目前已发现一些淋巴瘤存在对药物敏感的窗口期,在这期间给药能显著提升药效。
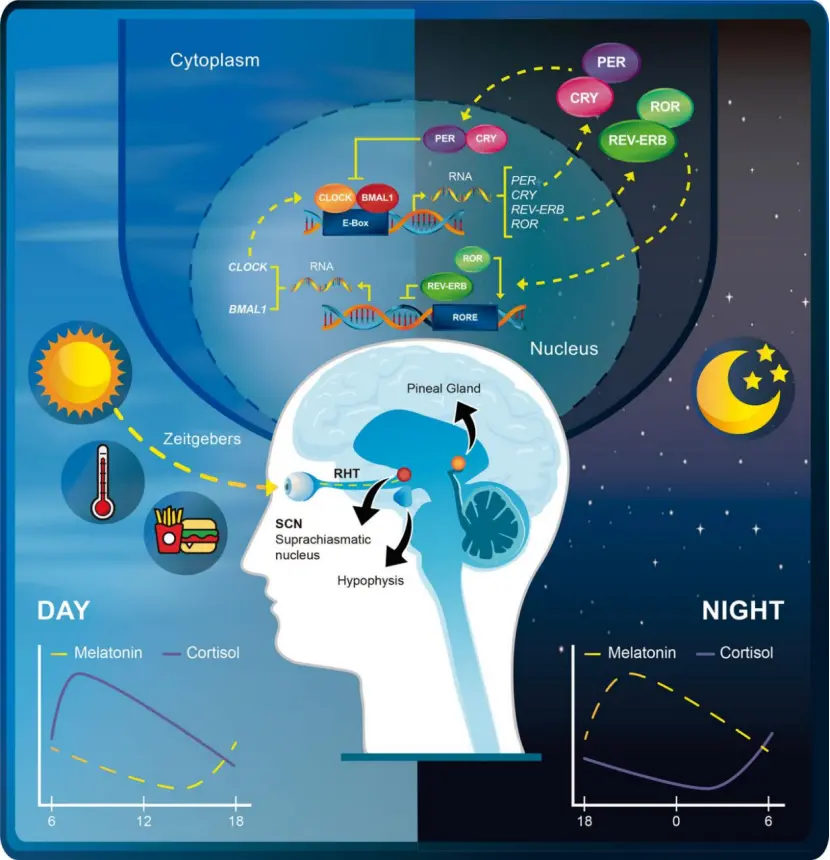
时间疗法(Chronotherapy)这个治疗概念,就考虑到新陈代谢和功能酶具有节律性,给药时需要寻找最佳时间,它也包括了给患者定时光照和补充褪黑素,以调整紊乱的节律,辅助治疗季节性疾病。
如果想利用节律来提升治疗效果,就要有恰当的方法来测量生物钟。在哺乳动物中,可用于测量节律周期的标志物包括褪黑素、核心体温最低值、血液中皮质醇水平等。目前,有多家团队在开发便捷准确且廉价的人体节律测量法,可以达到采血一两次就测出生物钟的程度。其中德国开发的检测方法已经非常接近临床应用,测量结果与使用褪黑素做标志物的结果差异仅在半小时之内。
如何调整节律,正在成为科学界的一个新课题。正如我们的肠胃还是原始人的肠胃,我们的节律基因也是原始的。可是近百年来,电灯照亮了夜晚,外卖成就了赖床,凌晨四点才下班的值夜班的人们,那些曾帮助原始人繁衍至今的节律基因仍试图维持24小时的睡眠-清醒、进食-空腹周期,现代生活方式却让它难以为继。
如果无法改变空中飞人或者倒班的生活,那么不妨尽量降低节律紊乱的负面影响。多项试验显示,白天小睡不会影响节律,但能降低压力,增加效率。
因为晨光能重置我们的生物钟,早上沐浴点阳光能对生物钟平稳运行有好处。现在有些宇航舱也设计成有明暗交替的周期,对缓解宇航员失眠大有裨益。
晚上则要避免光暴露,手机虽小,蓝光不少,睡觉的点儿就别再一边吃一边看短视频了。别人说“睡什么睡起来嗨”的时候,我们不嗨。
老子说:“动善时”,河上公注曰“动不失天时”,以现代眼光来看,这句话也可作为顺应天时规律生活、维持节律正常的小提醒,让我们的生物钟走得持久稳定。
















