美国疾控中心(CDC)国家环境卫生中心(NCEH)前主任,美国有毒物质和疾病登记局(ATSDR)前主任Portier博士2017年向法庭提交的草甘膦除草剂致癌性《专家意见》
【编译者说明:
1)“草甘膦除草剂致癌性”问题首先一个科学问题,必须由与草甘膦及其捆绑转基因产业毫无利益关系的独立科学家通过科学、客观、严谨科学实验与流行病学研究研究来评断,而不能由已经堕落为草甘膦及其捆绑转基因产业利益共同体者评断!
2)任何国家监管机构或国际组织监管机构,过去一旦渎职犯罪批准或支持草甘膦除草剂继续“农药登记”,它们就堕落与草甘膦及其捆绑转基因产业形成利益共同体,丧失了对草甘膦除草剂安全性评价的科学、客观、公正性,而且无法自拔解套!
3)美国疾控中心(CDC)国家环境卫生中心(NCEH)前主任,美国有毒物质和疾病登记局(ATSDR)前主任Portier博士,是该领域难得的有良知权威人士。2017年他向美国法庭提交的《专家意见》,对于“草甘膦致癌性”问题提交了最全面、最科学、客观、公正的证据链,值得中国毒理学工作者认真研读!
4)该《专家意见》非常详尽篇幅很长(原文供97页),本文仅节录其中“资质”、评估资料、“因果关系评估方法”,及其“草甘膦致癌性”关键性证据汇总部分。读者如果希望审查《专家意见》中对每篇研究文献的评述,建议访问本译文附录“证据”。
5)本文专业性非常强,建议一般读者仅阅读最前边的“资质”、“信赖清单”(评估的文献种类)与“因果关系评估方法”部分。
6)建议医学院校在校学生、医学工作者、毒理学专业人士,流行病学专业人士阅读内容更详尽的本译文附录“证据”全文。】
2017年10月,美国草甘膦除草剂致淋巴癌诉讼证词:Christopher J. Portier博士对于草甘膦除草剂致癌性向法庭提交的《专家意见》(案件3:16-md-02741 -VC 文件654-17,注册日期:2017年10月28日,共97页)
资质
我于1977年从(路易斯安那州)尼科尔斯州立大学(Nicholls State University)获得了数学学士学位,并在北卡罗来纳大学公共卫生学院分别于1979年和1981年获得生物统计学硕士学位与博士学位。我的博士学位论文探讨了设计一项为期两年的啮齿类动物致癌性研究的最佳方法,以评估一种化学品引起癌症的能力[1,2]。 大多数研究人员仍使用我论文中的最佳剂量模式。
我获得博士学位后的第一份工作是在美国环境健康科学研究所(NIEHS)和美国国家毒理学计划(NTP)的联合任命下,进行毒理学中通常使用的实验的设计和分析研究。
在NIEHS / NTP工作的32年中,我参与了我个人研究活动之外的许多国家优先事项。... 在NIEHS / NTP期间,我还担任与我的资格相关的行政职务。从2000年到2006年,我担任NIEHS的环境毒理学计划(ETP)主任。
我于2010年离开NIEHS/NTP,出任美国疾病控制与预防中心(CDC)的国家环境卫生中心(NCEH)的主任,同时担任有毒物质和疾病登记局(ATSDR)的主任。 NCEH进行研究并支持旨在减少环境危害对公共卫生的影响的活动。NCEH的一项备受推崇的研究工作是国家生物监测计划。该程序测试在美国全国人群中人体血液和尿液中是否存在数百种化学物质。
除了我在联邦工作中的职务外,我还担任过许多国家和国际科学咨询小组的成员。就本声明的资格而言,最值得注意的是,2005年至2010年期间我担任总统国家科学技术委员会毒理和风险小组委员会的主席,1998年至2003年期间担任美国环保署(EPA)科学顾问小组的成员和主席(特别关注关于为农药计划提供咨询的建议),同时担任国际癌症研究机构(IARC)咨询小组主席,该小组更新并改进了其审查科学数据的规则,以确保关于人体暴露致癌性的结论是最佳的(序言)[30]。...
我发表过250多篇关于毒理学与风险评估方面经同行审查的论文、专著章节与技术文件。...
我为美国环保署(EPA),美国食品和药物管理局(FDA),美国疾病控制与预防中心(CDC),国立卫生研究院(NIH),世界卫生组织(WHO)和国际癌症研究机构(IARC)的风险评估做出了贡献。
信赖清单
在准备本报告的过程中,我查看了以下材料:
a. 所有有关草甘膦制剂引起人类非霍金斯淋巴瘤(NHL)能力的流行病学数据。
b. 关于非霍金斯淋巴瘤(NHL)细胞起源的科学论文
c. 与草甘膦引起的致癌性,遗传毒性和氧化应激有关的同行评审科学数据
d. 被告向原告律师提供的有关草甘膦致癌性的技术报告
e.美国环保署(EPA)、欧洲食品安全机构(EFSA)、德国联邦风险评估研究所、欧洲化学机构、国际癌症研究机构(IARC)和世卫组织(WHO)/粮农组织(FAO)农药残留联席会议对与农药残留有关的科学文献审查草甘膦可能致癌的文件。
f. 欧洲食品安全机构(EFSA)提供的有关被告以外的组织准备的有关草甘膦的动物致癌性数据的技术文件
g. 诉讼中产生的其他各种文件
本报告结尾列出我依赖的文件的完整清单。
因果关系评估方法
草甘膦和/或草甘膦制剂(GBF)是否会引起人类非霍金斯淋巴瘤(NHL)的评估需要对人类研究(流行病学)、动物癌症研究以及研究化学物质导致癌症的机制进行研究的科学证据进行回顾和综合。许多不同的方法[31,32]用于综合这三个科学领域,以回答“这种化学物质是否会导致人类癌症?”的问题。在这三个科学领域中,任何一个领域必须对单个研究的质量进行评估和总结,以确保整体评估中所包括的研究适当完成。一旦评估了各个研究的质量,就需要对研究支持人类癌症发现的程度做出判断。为此,美国环保署(EPA),国际癌症研究机构(IARC),欧洲化学局(EChA),美国致癌物报告以及许多其他人使用的准则[30, 33-35]依赖于Hill(1965)[36]制定的“因果关系标准的方面”。
Hill列出了在评估因果关系时应考虑的流行病学研究和相关科学的九(9)个方面。这些方面中的任何一个的存在与否都不足以得出因果关系的推论。相反,这九个方面是回答其他解释是否比因果推断更可信的问题的手段。希尔指出:
“我的九种观点中,没有一种能够为因果假设提供支持或反对的无可争辩的证据,而且没有必要作为正当条件。它们或多或少可以做的事情是帮助我们对这个基本问题下定决心-- 是否有其他方法可以解释我们面前的那组事实,是否有其他相同或更多的答案,是更可能的原因与结果?”
Hill引用的9个方面包括:1) 观察到的关联的一致性,2) 观察到的关联的强度,3) 生物学上的合理性,4) 生物学梯度,5) 观察到的关联的时间关系,6) 观察到的关联的特异性,7) 连贯性,8) 来自人类实验和9) 类比的证据。这些将在下面简要描述。
当几项研究表明癌症与暴露之间存在一致的正相关性时,就可以加强因果关系的推断。这解决了重复研究的关键问题,这在大多数科学辩论中都至关重要。如果研究不一致,则应考虑研究质量、潜在混淆、潜在偏倚和统计功效方面的差异,以更好地理解这种不一致。
当在几项研究中观察到的关联的强度大且精确时,就可以加强因果关系的推断。这些大而精确的关联减少了观察到的关联是由于偶然或偏见而产生的可能性。患癌症的风险略有增加并不能排除因果关系,因为诸如效力和暴露水平之类的问题可能会降低研究识别更大风险的能力。荟萃分析对一些风险较小的研究进行了客观评估,以帮助阐明所观察到的关联强度。
当有证据支持通过实验证据证明的生物合理性时,因果关系的推论得到加强。动物致癌性研究(在评估暴露于纯草甘膦的实验动物中的肿瘤发生率)在建立生物学合理性中起着重要作用。可能导致癌症的机制类型很多[37],其中大多数可以通过在动物、人类细胞、动物细胞和/或其他实验系统中进行的实验研究来证明。偶尔,职业、意外或意外的人类接触使研究人员可以使用直接的人类证据来评估机制。
当存在生物学梯度显示暴露随变化而变化的合理风险模式时(例如,风险随着暴露增加或暴露时间延长而增加),则因果关系的推论得到加强。在许多流行病学研究中,由于研究设计的局限性或结果的表述不够清晰,无法对此方面进行检查。当研究确实解决了暴露-反应关系时,未能找到关系可能是由于暴露范围小,样本量不足或暴露量随时间变化而未考虑在内。
当存在暴露于癌症之前的时间关系时,因果关系的推论得到加强。这是显示因果关系所必需的。如果不存在,则不存在因果推论。由于癌症的潜伏期可能长(年),因此研究评估应考虑暴露时间是否足够长,才与癌症发展相关。
当暴露特定于给定的癌症时,因果关系的推论得到加强。这意味着正在研究的疾病终点仅是由于所评估的原因。这个问题很少适用,并且由于非霍金斯淋巴瘤(NHL)还有其他原因,因此特异性不适用于草甘膦的因果关系确定。
当其他实验证据与流行病学证据中所见关联的因果解释有一贯性时,就可以加强因果关系的推断。为了评估一贯性,将考虑来自动物致癌性研究、机理研究以及所研究化学物质代谢信息的信息。
在人类中有实验证据支持因果解释时,因果关系的推论得到加强。解决化学品的毒性时,很少有可用的此类信息。但是,在个人评估中减少或限制暴露量并降低癌症风险的实验将对评估产生重大影响(例如,评估与继续吸烟相比停止吸烟的人的癌症风险的研究表明,肺癌风险降低了)。没有可用的草甘膦此类数据。
最后,当存在其他具有类似性结构的化学试剂在人和/或动物中表现出相似的作用和/或在机理研究中显示出相似的生物学影响时,因果关系的推论得到加强。没有可用的草甘膦此类数据。
推论因果关系的最合乎逻辑的方法是逐步骤研究Hill (1965)[36]提出的因果关系的各个方面,并将其应用于草甘膦和草甘膦制剂的可用数据。这在以下各节中完成。
在人类流行病学研究中所见关联的一贯性
相关流行病学研究
【注:对每篇研究文献的评述在此从略,如果希望审查,请访问本译文附录的“证据”】
Chang and Delzell (2016)[38]...Cantor et al. (1992)[39]...De Roos et al. (2003)[43]...Zahm et al. (1990)[51]...Hoar et al. (1986)[52]...Lee et al. (2004)[44]...Nordstrom et al. (1998)[40]...Hardell and Eriksson (1999)[41]...Hardell et al. (2002)[42]通过结合Nordstrom et al. (1998)[40]与Hardell and Eriksson (1999)[41]...Hardell et al. (2002)...Eriksson et al. (2008)[46]...McDuffie et al. (2001)[50]... Hoar et al. (1986)[52]...Zahm et al. (1990)[51]...Hohenadel et al. (2011)[48]...McDuffie et al. (2001)[50]...Chang and Delzell (2016)[38]...Orsi et al. (2009)[47]...Cocco et al. (2013)[49]...De Roos et al. (2005)[45]...
关联一贯性
Hill (1965)[36]将一致性定义为对“是否由不同的人在不同的地点、环境和时间反复观察到这个问题”的回答“是”。对于这些研究,答案的确是肯定的。
如果草甘膦与非霍金斯淋巴瘤(NHL)关联的人群相对危险度(PRR)等于1(无作用),则可以预期多项研究中的统计学显着性结果极少,并且约有一半的研究的OR或RR均低于1一半以上。正如国际癌致研究机构(IARC)专著112( IARC Monograph 112, 2015)[56]和Chang and Delzell (2016)[38]所指出的,在比较研究时,最合理的比较是使用调整最充分的风险估计。我主要将我的评论仅限于这些经过最充分调整的风险估算。
多个流行病学研究之间的关联一贯性不仅是查看有多少统计学意义上的显着性,还有不是显着的,还必须解决响应方向的一贯性。图1显示了先前讨论的流行病学研究中所有OR和RR的森林图。森林图中的每条水平线均以黑色正方形表示OR / RR的平均估计值,并且随着晶须从黑色正方形向左和向右延伸,该估计值周围的95%置信区间为该值。
从图1得出的第一个显而易见的结论是,所有平均OR / RR估计值(黑色正方形)始终≥1。这意味着所有的研究都朝着积极的方向发展。在他们的荟萃分析中,Schinasi and Leon (2014)[57],IARC (2015)[56]以及Chang and Delzell (2016)[38]均将6篇论文(图1中以红色突出显示)确定为评估草甘膦诱导人产生NHL的能力最可靠的论文:McDuffie et al. (2001)[50],Hardell et al. (2002)[42],De Roos et al. (2003)[43]和De Roos et al. (2005)[45],Eriksson et al. (2008)[46]和Orsi et al. (2009)[47]。我将这些论文称为六种流行病学核心研究。如上所述,如果真实的潜在风险比率为1(无影响),则您会期望约一半的发现低于1,一半等于1或更大。仅使用6个核心研究的结果,您会发现所有≥1;发生这种情况的可能性为(0.5)6或0.016,强烈表明研究与潜在的PRR = 1不符,并且它们始终支持阳性的作用。
评估一贯性的第二种方法是使用荟萃分析将各个研究合并,以使用OR和RR(CRR)进行合并分析,并检验研究中的异质性。Chang and Delzell (2016)进行的荟萃分析与IARC (2015)进行的分析相同,是对Schinasi and Leon (2014)的改进,因此,我将集中讨论使用Chang and Delzell (2016)荟萃分析。Chang and Delzell (2016)使用两种不同的方法(随机效应模型和固定效应模型)对草甘膦流行病学研究进行了四个单独的荟萃分析。在他们的第一个分析(模型1)5中,他们结合了六项核心研究中经过最充分调整的风险估计,得出随机效应模型和固定效应模型的CRR为1.27(1.01-1.59),从而支持了在这些研究中接触非霍金斯淋巴瘤(NHL)和草甘膦相关。在第二种分析(模型2)中,它们逻辑回归分析的结果,随机效应模型和固定效应模型的CRR为1.30(1.03-1.64)替代了De Roos et al. (2003)的贝叶斯分析结果。在第三次分析(模型3)中,他们从模型1中用他们从来自Hohenadel et al. (2011)的分析合并的荟萃分析结果(该研究重新分析了与McDuffie et al. (2001)相同的数据,将哮喘患者和非哮喘患者之间的结果进行了划分)替代了McDuffie et al. (2001)的结果,对随机效应模型和固定效应模型得出CRR为1.32(1.00-1.73)的结果。最后,在第四种分析(模型4)中,他们使用模型3,用通过logistic回归分析得出的结果取代了De Roos et al. (2003)的贝叶斯分析,得出随机效应模型和固定效应模型的CRR为1.37(1.04-1.82)。从本质上讲,所有不同的荟萃分析均未拒绝组合的、统计学上显着的阳性影响的概念。

图1:来自某些流行病学研究和Chang and Delzell (2016)的荟萃分析中,经过最充分调整的风险估计的赔率和比率比率。 “ RR”是指研究中的OR或RR,“ Lower”是指95%的下限,“ Upper”是95%的上限,“ Weight”是指应用于模型1中特定研究的权重 荟萃分析(Chang and Delzell (2016)中的表3)。 对于De Roos et al. (2003),第一行用于贝叶斯模型分析,第二行标记为“逻辑回归”,来自逻辑模型分析。
如上所述,评估流行病学数据一贯性的另一种方法是评估研究的异质性。异质性可能是由于参与者、结果、暴露量度、对研究对象的质疑方法、对象性别等的差异所致。Chang and Delzell (2016)使用Cochran的Q统计量和C检验了六项核心研究结果的异质性。 I2统计信息[58]。对于模型1-4,来自Cochran Q检验的p值分别为0.84、0.59、0.85和0.63(通常,如果p <0.10,则您拒绝同质研究的概念,而支持异质研究)。所有四个模型的I2统计量均为0.0%(I2的值范围可以在0-100%之间,并且考虑到异质性高于50%)。固定效应模型和随机效应模型给出相同结果的事实也支持数据缺乏异质性。在这六项核心研究中没有迹象表明存在异质性。缺乏异质性支持对荟萃分析的解释,因为这表明在六项核心研究中发现存在正相关和强烈一贯性。
Chang and Delzell (2016)还在可能的情况下评估非霍金斯淋巴瘤(NHL)亚型与草甘膦暴露之间的关联。对于B细胞淋巴瘤,他们结合了Eriksson et al. (2008)[46]的结果和Cocco et al. (2013)[49]的研究,并看到CRR(随机效应和固定效应)为2.0(1.1-3.6),I2为0,Cochran Q检验p值为0.58。对于弥漫性大B细胞淋巴瘤,他们结合了Eriksson et al. (2008)[46]的结果和Orsi et al. (2009)[47]的研究,并看到CRR(随机效应和固定效应)为1.1(0.5-2.3),I2为0,Cochran Q检验p值为0.79。对于合并的慢性淋巴细胞性白血病和小淋巴细胞性淋巴瘤,他们将Eriksson et al. (2008)[46]的结果和Orsi et al. (2009)[47]的研究结合在一起,并看到CRR使用1.3(0.2-10)的随机效应模型和1.9(0.9-4.0)的固定效应模型,I2为83.7%,Cochran's Q检验p值为0.01。对于滤泡性淋巴瘤,他们结合了Eriksson et al. (2008)的结果[46]与Orsi et al. (2009)[47]的研究一样,并看到CRR(随机效应和固定效应)为1.7(0.7-3.9),I2为0,Cochran Q检验p值为0.73。最后,对于毛细胞白血病(HCL),他们结合了Nordstrom et al. (1998)[40]的结果和Orsi et al. (2009)[47]的研究,并看到CRR(随机效应和固定效应)为2.5(0.9-7.3),I2为0,Cochran Q检验p值为0.63。这些亚型分析基于少量病例,只有两项研究使它们在单独考虑时无法可靠地解决数据一致性问题。但是,将它们与NHL核心研究的荟萃分析结果相结合时,这些研究为这些数据一贯性的结论提供了支持。
Chang and Delzell (2016)也对仅具有相似特征的研究进行了荟萃分析,从而进行了敏感性分析。 使用仅五项病例对照研究,CRR为1.3(1.0-1.7)。将它们分为所使用的对照类型,使用的人口对照的四项研究CRR为1.4(1.0-1.8)。对仅男性的四项研究的CRR仅为1.3(1.0-1.7),对男性和女性的两项研究的CRR为1.2(0.8-1.8)。 在北美进行了三项研究,其CRR为1.2(1.0- 1.6),在欧洲进行了三项研究,其CRR为1.3(0.8-2.1)。 这三项研究中有两项在瑞典进行,其CRR为1.6(0.9-2.8)。 对于固定效应模型和随机效应模型,所有产生的主要CRR均相同。 该敏感性分析表明,六项核心研究相结合的结果与各自研究的主要CRR相比相差无几,这为不同研究中一贯性的发现增加了支持。
在案例对照研究中,当案例和对照选择参加研究的原因可能导致系统性偏见时,就会出现选择偏见,而这些偏见可能导致与所研究的暴露无关的阳性或阴性结果。例如,如果有暴露的病例比有暴露的对照更有可能参与,那么结果将是更高的OR值;但是,这种差异必须是差异性的,而不仅仅是参与率的差异。在其中的一些研究中,选择对照的方法可能会导致选择偏倚,从而导致OR升高。但是,鉴于五项核心病例对照研究中使用的病例和对照类型多种多样,这不太可能解释这些研究中发现的一贯性发现。如果未完成问卷/访谈的原因在病例和对照之间不同并且与暴露有关,则缺乏病例与对照的完整数据也可能导致选择偏倚。这些报告中没有迹象表明这种选择偏见,这不可能解释这些数据中的一致性。
在病例对照研究和队列研究中,暴露分类错误可导致OR或RR值增加或减少。 例如,在病例对照研究中,如果病例比对照更有可能说他们接触了草甘膦,则这会增加OR值;这是召回偏见的一种。在队列研究中这种类型的偏见可能性较小。 在所有六项核心研究中,作者都讨论了这个问题。在每种情况下,他们均得出结论,一定会有一些暴露分类错误,但很可能是非差异性的,这意味着错误分类是随机的; 这可能会减少研究中看到的OR / RR,而不是增加它们。
当存在与草甘膦接触和非霍金斯淋巴瘤(NHL)诊断密切相关的接触或某些其他因素从而造成混淆,如果能够加以控制,则可以解释结果。这些研究中最有可能引起混淆的原因是接触其他农药。六项核心研究中有四项[42, 43, 45, 46]控制了与其他农药的接触,并且发现的结果与其他两项研究基本相同。另一个令人困惑的问题是,这些病例是否存在与NHL相关的免疫缺陷;在所有病例对照研究中,此类病例均被排除在外。最后,其他农业暴露(例如动物、其他化学物质、传染原)可能与草甘膦暴露相关,并可能与NHL相关;没有一项研究能控制这些因素。但是,并非所有暴露的病例都是农民。如果通过其他农业暴露也造成混淆,则无法从这些数据确定这种影响的大小或方向。
总之,我们有四个不同的研究小组在两个不同的大陆上使用不同的设计、调查表和研究人群进行的六项核心流行病学研究,这些研究高度一致,没有明显的偏倚或不能解释结果的混淆。 六个核心研究之间的关联是一致的。
[50] McDuffie,H.H.,et al., Non-Hodgkin'slymphomaandspecificpesticide exposures in men:cross-Canadastudyof pesticidesand health. Cancer EpidemiolBiomarkersPrev,2001.10(11): p.1155-1163.
[42] Hardell,L.,M.Eriksson,andM. Nordstrom,Exposuretopesticidesasriskfactorfornon-Hodgkin'slymphomaandhairycellleukemia:pooledanalysisoftwoSwedishcase-controlstudies. Leuk.Lymphoma,2002.43(5):p.1043-1049.
[43] DeRoos,A.J.,et al.,Integrative assessmentofmultiplepesticidesasriskfactorsfornon-Hodgkin'slymphomaamongmen. OccupEnvironMed,2003.60(9): p.E11.
[45] De Roos,A.J.,etal.,Cancerincidenceamongglyphosate-exposedpesticideapplicatorsintheAgriculturalHealthStudy. EnvironHealthPerspect,2005.113(1):p.49-54.
[46] Eriksson,M.,etal.,Pesticideexposureasriskfactorfornon-Hodgkinlymphomaincludinghistopathologicalsubgroupanalysis. IntJCancer,2008.123(7):p.
[47] Orsi,L.,etal.,Occupationalexposuretopesticidesandlymphoidneoplasmsamongmen:resultsofaFrenchcase-controlstudy. OccupEnvironMed,2009.66(5): p.291-8.
这六项核心流行病学研究,所有研究均显示(草甘膦与非霍金森淋巴瘤之间关联)优势比(OR)/相对危险度(RR)大致相同,适度增加,如果组合起来,则显示出显着的关联强度。六个核心研究之间有着很强的联系。
确定草甘膦与非霍金森淋巴瘤之间关联因果关系的汇总分析方法
在来自不同实验室对同一实验动物模型进行多种致癌性研究是不寻常的。科学文献中也没有描述对多种动物癌症生物测定的组合分析方法。但是,如流行病学[92,93]中所进行的汇总分析方法也可用于组合动物致癌性研究。基本概念是将来自相同性别/物种/品系的所有数据汇总到一项研究中并进行适当分析。基本步骤是:1)选择要汇总的研究;2)合并数据进行分析;3)评估研究的具体效果;4)估计合并效应;5)解释合并效应与个别效应之间的差异;6)尽可能进行敏感性分析。这些步骤将用于分析动物致癌性研究的汇总数据,其中按性别、物种、品系和暴露时间进行汇总,以限制汇总研究中异质性。《联邦杀虫、杀菌和灭鼠法》(FIFRA)科学咨询小组在针对环保署(EPA)的草甘膦致癌性问题向EPA提出的建议中[54],强烈支持引用我对EPA的评论[94],使用汇总分析来解决一致性问题。
Lankas et al. (1981)[74]的研究中,50只雄性与50只雌性SD大鼠接触于饲料中草甘膦(98.7%纯度)26个月(参考表1看剂量)。
这个研究与OECD(经济合作与发展组织)指导原则不一致(从事该项研究时在OECD指导原则发布前),但是,如同EFSA(欧洲食品安全机构)[89]注明的那样,该项研究与OECD1981年指导原则大体一致。对于该项研究的信息可以从美国环保署(EPA)[61]、EFSA[89]、Greim et al.[91]获得,以及由Bio/dynamics Inc.实验室做的原研究报告[95]以及孟山提供给EPA的备忘录获得。
在雌鼠中观察到甲状腺C-cell癌增加(pTrend=0.003)(表1),但是将腺瘤和癌合并在一起只是略微增加(pTrend=0.072)。孟山都邀请来的独立毒理学家争辩说这些肿瘤没有进行相关处理。作者提供了癌症和癌的联合来自九个对照组的腺瘤的历史对照数据,对于癌的平均反应为4/453 = 0.9%,对于联合肿瘤为46/453 = 10.2%。 使用历史控制数据,两个结果的统计学意义都没有改变。
作者们还提到胸腺和淋巴结中淋巴细胞增生的发生率略高于对照组(p趋势=0.143)。中间剂量组与对照显著区别(pFisher=0.018)。
这项研究中还发现胰岛细胞瘤在最低剂量组雄鼠中统计显著增加(pFisher=0.028)(表1),但是在其他剂量组没有这种情况;趋势测试不显著(p趋势=0.312)。
这项研究SD大鼠中用的最高剂量远低于MTD(最大容忍剂量)。尽管欧洲食品安全机构(EFSA)[89]注明这项研究大体符合OECD(经济合作与发展组织)指导原则,然而,他们由于使用的低剂量的情况认为它不符合现行的指导方针而将其驳回。EPA[61]也将这项研究排除在考虑之外。然而,该研究发现的男性睾丸肿瘤和女性甲状腺C细胞癌增加,有必要仔细评估确定因果关系。此外,这是最长时间(26个月)的研究,为整体评估提供了独特的信息。
表1中其他研究使用SD大鼠也见到显著增加的其他肿瘤也列出来。
表1:Lankas (1981)[74]26个月喂养研究雄性与雌性SD大鼠中令人关注的肿瘤

总之,本研究显示雄性SD大鼠睾丸间质细胞瘤和肝细胞腺瘤的阳性结果,以及雌性SD大鼠甲状腺c细胞癌的阳性反应,将纳入对(草甘膦-致癌)因果关系的整体评估。
Stout and Ruecker (1990)[78]研究中,50只SD雄鼠与50只SD雌鼠接触于饲料中草甘膦24个月(具体剂量间表2)。这项研究依照OECD(经济合作与发展组织)指导原则进行。
该研究中没观察到存活差别,也没有表明使用的最高剂量超过了最高容忍剂量。
在所有剂量组中,相对于雄性大鼠对照组,胰岛细胞肿瘤增加,并且对于最低(pFisher = 0.015)和最高(pFisher = 0.032)剂量组(表2)统计学显着。但是,这些比率包括一年中处死的10只动物。在一年内终止的大鼠,由于接触时间短,可能没有发生这种肿瘤的风险;将一年处死的这些动物包括在最终肿瘤计数中是非常罕见的(EPA [61]也排除了这些动物)。在本研究的病理学表中,在临时处死的10只动物中没有任何肿瘤。去除这10只动物不会改变趋势或Fisher精确检验的p值。该实验室中该肿瘤的历史对照数据报告为23/432或5.3%[96],与该控制率的趋势比较并不显著(p历史t = 0.15)。这种趋势的缺乏由回应的上下性质驱动。假设5.3%的历史比率正确,那么在47只动物中发现8个或更多肿瘤的概率是0.003。与此类似,对于中剂量和高剂量,这个概率分别为0.124和0.014。雌性没有表现出这种肿瘤增加。作者提供了一个表,其中包含自该研究的胰岛 - 细胞腺瘤和癌的以及来自Lankas等人(1981)[74]研究的肿瘤计数合并结果,作者们争辩认为这样的结果不显示与剂量相关的增加。喂养26个月研究的动物与喂养24个月研究的动物对相同化学物质和非常不同的对照发病率可能具有非常不同的反应。
在雄性大鼠中,除去中期处死的动物后,肝细胞腺瘤有统计学显著性趋势(p趋势= 0.015),腺瘤和癌合并有显著增加(p趋势 = 0.05,表2),但雌鼠没显示(未显示)。 肝癌通常也在单独的分析中提供,但这些数据不是作者提供的(数据表明肝细胞癌将具有负面趋势)。
无论是否包括临时处死动物(表2),雌性大鼠甲状腺C细胞腺瘤也显着增加(p趋势 = 0.049),而且腺瘤和癌合在一起未边际增加6(p趋势 = 0.052)。 在雄性中,腺瘤趋势为p趋势 = 0.084,对于腺瘤和癌一起p趋势 = 0.091。 在中期处死雄性大鼠中观察到腺瘤,表明中期处死雄性大鼠时处于该肿瘤风险中。如果将这些动物重新添加到分析中,则雄性趋势测试对于腺瘤为p趋势 = 0.063,对于腺瘤和癌合并在一起为p趋势 = 0.068。
其他SD鼠喂养研究中显示显著的其他几种肿瘤也包括在表2中,它们在本研究中没有显示显著作用。
作为结论,这项研究中发现胰岛细胞瘤发病率增加,不能作为偶然发现轻易排除。 发现雄性大鼠肝腺瘤显著增加而癌未增加的结果到可能是偶然的。应该将雄性和雌性鼠甲状腺c细胞肿瘤显著增加的发现与其他研究进行比较。 这项研究将被纳入因果关系整体评估中。
表2:Stout and Ruecker (1990)[78]24个月喂养研究中雄性与雌性SD大鼠中令人关注的肿瘤。

Atinson et al. (1993)[68] 对草甘膦(98.9%纯度)进行了一项慢性毒性/致癌性结合在一起的研究。他们在两种性别各自使用了50只SD大鼠,表3中列出其饮食接触剂量。还包括额外35只大鼠/性别/剂量做中间期处死。
该项研究中没有存活差异,也未表明使用的最高剂量超过最高容忍剂量。
表3:Atkinson et al. (1993)[68]SD大鼠24个月喂养研究中引人关注的肿瘤

研究作者报告没有显著影响,EPA(美国环保署)[61]与EFSA(欧洲食品安全机构)[89]也如此报告。该研究没有所有组所有动物对每种肿瘤类型进行详细组织病理学检查,但是检查了所有对照组和高剂量动物,而且坚持了研究终止前死亡的所有动物和在研究终止时显示肉眼可见肿瘤的动物;还检查了所有动物的肝、肾和肺。 这严重削弱了该项研究对剂量反应趋势的研究。 然而,在回顾Greim et al.(2015)提供的病理学表格时[91],通过趋势检测发现甲状腺滤泡性腺瘤和癌有轻微显著性(p趋势= 0.099)。 如果三个中间暴露组没有看到其他肿瘤,并且分母是整个50只动物研究,趋势分析变得显着(p趋势= 0.034)。
对研究结束处死的没有大肿瘤动物进行病理检查情况下,这项研究的发现对因果关系整体评价只能给予较小权重。
Brammer (2001)[69]在Wistar鼠中进行了两年致癌性研究,每组52只动物接触草甘膦(97.6%纯度),表4列出各组剂量。额外12只动物在一年时处死。
EPA(美国环保署)指出生存率中显著阳性趋势(p=0.03),然而这样的趋势不是使用Kaplan-Meir测试[97](本应当使用的合适试验)实现的,而是简单相对与研究结束时处死动物的百分百。没有表明使用的最高剂量超过了最高容忍剂量。
EPA(美国环保署)[61],而非EFSA[89],指出与对照组比较雄鼠最高剂量组中肝细胞腺瘤有统计显著趋势。趋势分析给出p趋势=0.008,与此相比,Fisher的研究中高剂量组相对于对照组的相同测试结果为p趋势=0.027。美国环保署驳回了这一发现,可能是由于本研究与对照组的终末处死动物数量略有不同。然而,没有提供正式的生存统计评估,也不能从这些数据中推测这些动物中生存率显著受到影响。Greim et al.(2015)[91]对这种肿瘤使用了略微不同的数字,因为中期处死组中的三只动物(对照组中一个,低剂量组中一个和中剂量组中一个)在其中间处死时间之前就死亡了,从他们论文中提供的病理学表格中可以看出,它们不能与其他病例分开。这些数字被列入表4,而且并未改变研究结果的显著性。 Greim et al.(2015)[91]的研究排除了这些发现,部分原因与EPA(美国环保署)使用的生存论点相同,部分原因是他们有一个历史对照数据集,其历史响应范围为0-11.5%;他们没有提供这些历史对照的平均反应或个体肿瘤反应数据。如前所述,因为某些数据处于历史对照范围内而忽略结果是一种使用历史对照来评估研究的不可接受的方法,在这项研究情况下,没有理由对所使用的对照提出质疑。
表4:Brammer(2001)Wistar鼠24个月喂养研究中雄鼠与雌鼠令人关注的肿瘤

我获得了Charles River实验室2003年至2011年16组Wistar鼠历史性对照[98]。虽然它们超出了Brammer(2001)研究中所用动物的最佳时间范围,但它们可以说明为什么使用范围可能会产生误导。在1217只对照动物中观察到52个肝腺瘤,平均反应为4.27%,范围为0%至17.5%(个体研究结果为6/100,0/60、1/60、1/50、1/80、14/112、1/65、0/60、21/120、0/50、1/50、2/60、0/50、1/100、1/150、2/50;13个研究%响应≤2的)。假设对照组患肿瘤的潜在可能性为4.27%,p历史 = 0.006(表4)。 因此,尽管Brammer(2001)中看到的反应在历史控制范围内,但当适当使用历史控制时,这种趋势非常显著。Greim et al.(2015)也提到了在高剂量时毒性增加的发现,但他们仅提供了对于肝细胞脂肪空泡化和肝炎的数据;对任何测试这些发现均无统计学意义。
总之,这项研究显示了雄性Wistar大鼠肝细胞腺瘤的阳性结果,这项研究将纳入对因果关系的总体评估。
Suresh, (1996)[79]让Wistar鼠接触喂养中草甘膦(96.8%纯度)两年。表5中列出50只动物/性别在四组中试验的情况。
这项研究中没有生存差别,而且所使用的最高剂量没有表明超过最大容忍剂量。
EPA(美国环保署)[65]对这项研究结论没有肿瘤由于接触草甘膦增加,EFSA(欧洲食品安全机构)[89]的结论为,“任何显著显微观察的改变、发生率增加或减少(肝、脾、淋巴结、肾上腺、胸腺、性腺、子宫、乳腺中)被观察到表明剂量关系,因而看来是事故性而并非与试验成分出来相关”(第491页)。
表5: Suresh (1996)[79]的24个月喂养研究中雄性与雌性Wister鼠中引人关注的肿瘤
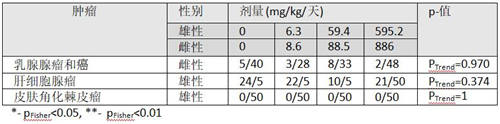
Enemoto (1997)[72]的研究中让SD大鼠接触喂养中草甘膦(95.7%纯度)两年。对四个接触组中50只动物/性别进行测试(参看表6)。此外,每个接触组10只鼠接触草甘膦1年,另外10只鼠接触18个月然后处死检查。这些组中中期处死动物(1年与18个月)如果看到肿瘤就也包括在分析中。
这项研究中没有生存差别,而且最高剂量不现实超过最高容忍剂量。
EPA(美国环保署)与EFSA(欧洲食品安全机构)在任何组中都没有发现肿瘤中显著改变。Greim et al. (2015) 再次提供了肿瘤数量表,除了雄鼠中肾腺瘤发生率(p趋势=0.004,表6)外,未显示任何其他显著效应。
对Greim et al. (2015) 提供的病理学检查表的审查,未揭示肿瘤发生率随剂量增加的任何其他肿瘤。对SD鼠进行的另外一项研究[74],显示乳腺腺瘤、甲状腺C细胞癌、皮肤角化棘皮瘤和睾丸间质细胞瘤强烈显著趋势,因此这些数据也包括在表6中进行比较。
这项研究显示肾腺瘤中显著增加,将包括在因果关系整体评估中。
表6:Enemoto (1997)[72]的24个月喂养研究中雄性与雌性SD鼠中引人关注的肿瘤

Wood et al. (2009)[80]研究中让Wistar鼠接触饲料中草甘膦(94.7%-97.6%纯度)两年。在四个接触组中对五十一只动物/性别进行试验,剂量在表7中列出。
EFSA(欧洲食品安全机构)[89]未发现随剂量增加的肿瘤,但是EPA(美国环保署)指出乳腺腺瘤和腺癌结合在一起增加而且对腺瘤p趋势=0.062,对腺癌p趋势=0.042,而对肿瘤结合在一起p趋势=0.007(表7)。EPA结论,没有腺瘤到腺癌的进展并争辩说观察到的增加非草甘膦相关。这样的结论与对照组和低剂量组中6只动物发生腺癌但是这两组中没有任何动物发生腺瘤的事实矛盾。这看来,在这种情况下,乳腺腺癌可以在不存在任何腺瘤情况下发生。
Greim et al (2015)[91]也指出雄鼠中皮肤角化棘皮瘤增加(p趋势=0.030)。对病理学表的审查没有发现任何肿瘤随剂量增加。另外一项研究发现Wistar鼠[69]中肝细胞腺瘤中强烈显著趋势,所以这种肿瘤也包括在表7中比较。
这些研究显示雌鼠中乳腺肿瘤与雄鼠中皮肤角化棘皮瘤增加,将在因果关系评价中使用。
表7:Wood et al. (2009)[80]的研究中Wistar鼠24个月喂养研究雄鼠与雌鼠中引人关注的肿瘤

联合分析
表8总结对老鼠研究中引入关注所有肿瘤的显著性。Brammer(2001)[69]观察到随着剂量增加,雄性Wistar大鼠的肝细胞腺瘤显着增加(p趋势= 0.008,表4)。 Wistar大鼠中另外两项可接受的研究(Wood等人(2009)[80]和Suresh(1996)[79])没有显著增加(表5和表7)。根据统计学显著性,这些研究相互之间不一致。
如同在硬币三次翻转中结果是一个正面和两个反面来拒绝不公平那样,仅凭1/3阳性就拒绝研究的发现也不公平,而且有更好的方式来解决这些发现。鉴于不同的剂量和不同的样本量,我们需要正式测试这些研究的一致性。
Suresh(1996)在对照组中观察到48%的肝细胞腺瘤反应,而另外两项研究在对照动物中没有看到肿瘤。因此,虽然所有三项研究都是Wistar大鼠中研究,但Suresh(1996)与另外两项研究的对照反应显著不同。Suresh(1996)没给出使用了Wistar大鼠何种亚种,但Brammer(2001)和Wood等人(2009年)使用了Wistar大鼠不同的亚种。三项研究使用不同的饮食,并在不同的设施进行。因此,对Suresh(1996)的显著不同比率没有明显的解释。已知来自不同实验室的同品种大鼠可能具有显著不同的对照肿瘤响应。由于他们有类似的对照响应,可以将Brammer(2001)和Wood等人(2009年)的研究汇集到一项研究提出这样的问题:“将Brammer(2001)的研究与Wood等人(2009)的负面研究汇合在一起进行研究时,Brammer(2001)的显著趋势是否会消失?”对合并研究的分析得出p趋势 = 0.013,这支持了草甘膦导致具有类似背景响应的Wistar大鼠肝细胞腺瘤的结论。
Wood et al. (2009)[80]的研究见到其他两项研究(表4与表5)中没有看见的雌鼠中乳腺腺瘤和腺癌显著增加(p趋势=0.007,表7)。这些研究中的背景发生率仅稍微不同,而且对所有三项研究在一起的汇总分析得到p趋势A=0.459,提议将这些数据结合在一起排除了Wood et al. (2009)研究中看到的剂量-响应趋势。然而,如果Suresh (1996)研究中食用的Wistar鼠对肝细胞腺瘤的响应有所不同,它们对这种肿瘤的响应可能也有所不同。仅将Wood et al. (2009) 研究与Brammer (2001)研究结合在一起的结果为 p趋势=0.037。考虑到汇总对这种肿瘤在一起的结果,我得出的结论是它们对草甘膦可能导致Wistar大鼠乳腺腺瘤和腺癌的观点支持有限。
Wood et al. (2009)[80]的研究看到另外两项研究(表4与表6)中没有见到的皮肤角化棘皮瘤显著增加(p趋势=0.030,表7)。这些研究中的背景发生率仅稍微不同,而且对所有三项研究在一起的汇总分析得到p趋势A=0.010,提议将这些研究数据汇总在一起不排除Wood et al. (2009)的研究中见到的剂量-响应趋势。仅将Wood et al. (2009)研究与Brammer (2001)研究结合在一起的结果为 p趋势=0.053。考虑到汇总对这种肿瘤在一起的结果,我得出的结论是它们支持草甘膦可能导致Wistar大鼠皮肤角化棘皮瘤的观点。
在SD大鼠中,有四项研究被纳入评估因果关系,其中一项[74]对雌鼠甲状腺C细胞癌与对雄鼠睾丸间质肿瘤和肝细胞腺瘤获得强烈阳性响应,其他一项[72]对雄鼠肾腺瘤产生强烈的结果。Lankas (1981)[74]的研究看到暴露于草甘膦雌鼠中甲状腺C细胞癌显著增加(p趋势=0.003,表1)以及C细胞腺瘤和癌综合分析时略微增加(p趋势=0.072, p历史=0.072,表1);其余三项研究中的一个也见到雌鼠中甲状腺C细胞腺瘤和癌略微增加(表2)。使用所有四项研究数据综合分析得到p趋势A=0.390。这样的综合分析不支持Lankas (1981)研究中看到的结果。然而,Lankas (1981)的研究为26个月,而其他三项研究为24个月;C细胞癌可能是更长暴露时间的结果,尽管研究中的剂量显著低于其他两项研究的剂量。从这些数据,我结论,草甘膦在雌性SD鼠中造成甲状腺C细胞肿瘤的证据较弱。
甲状腺C细胞腺瘤和癌结合在一起,在Stout and Ruecker(1990,表2)的研究显示边际显著剂量-响应趋势,但是其余三项研究没见到这样的趋势。将四项研究一起综合分析得到显著趋势p趋势A=0.041。从这些数据,我结论有证据表明草甘膦在雄性SD鼠中造成甲状腺C细胞肿瘤。
甲状腺滤泡细胞腺瘤和癌结合在一起,在Atkinson et al. (1993,表3)的研究显示显著剂量-响应趋势,但是其余三项研究未见这样的趋势。将四项研究一起综合分析得到显著趋势p趋势A=0.618。从这些数据,我结论没有证据表明草甘膦在雄性SD鼠中造成甲状腺滤泡细胞腺瘤。
在Stout and Ruecker (1990)的研究在雄鼠中显示肝细胞腺瘤有显著剂量-响应趋势(表2),但是其余三项研究未显示。将所有四项研究综合分析得到边际显著趋势p趋势=0.073。从这些数据,我结论有限证据表明草甘膦在雄性SD鼠中造成甲状腺滤泡细胞腺瘤。
表8:老鼠中7项研究对5种肿瘤显著测试总结

1输入值为带值的p趋势/p历史: – p>0.1, + 0.1≥p>0.05, ++ 0.05≥p>0.01, +++ p≤0.01;2仅Brammer (2001) 研究与 Wood (2009) 研究的综合分析结果;3肝肿瘤结节;4不包括Lankas (1981)研究。
SD大鼠中见到的另外一个显著趋势是Lankas(1981)[74]研究中发现的睾丸间质细胞瘤(P趋势=0.009,表1);其余三项研究对这种肿瘤阴性(表2、表3与表6)。将其余三项研究与Lankas(1981)研究结合在一起对睾丸间质细胞瘤的趋势综合分析得到的p值为清楚不显著(p趋势A=0.608)。然而,如上边注明的那样,Lankas(1981)研究是26个月研究而另外两项研究为24个月研究;这样的肿瘤可能是更长暴露期间的结果,尽管Lankas(1981)研究中使用的剂量显著低于StoutandRuecker(1990)、Atkinsonetal.(1993)与Enemoto(1997)研究中使用的剂量。
从Enemoto(1997)[72]的研究,SD大鼠中表明一种强烈显著趋势的最终肿瘤为雄鼠肾腺瘤(P趋势=0.004,表6)。Lankas(1981)[74](表1)、Atkinsonetal.(1993)[99](表3)与StoutandRuecker(1990)[78](表2)的研究中肾肿瘤数据不显著。将Enemoto(1997)的研究与Lankas(1981)[74]、StoutandRuecker(1990)和Atkinsonetal.(1993)的研究数据综合分析得到p趋势A=0.201。去除26个月的Lankas(1981)[74]研究后,其余三项24个月的研究的p值为p趋势=0.031;因此,草甘膦与肾腺瘤关联得到这些数据的支持,甚至Atkinsonetal.(1993)的研究低剂量与中剂量组结果难于解释的关联也支持这样的关联。
有证据支持暴露草甘膦增加雄性SD鼠中肾肿瘤。
总之,有证据表明草甘膦在雄性Wistar大鼠中造成肝细胞腺瘤和皮肤角化棘皮瘤,在雌性Wastar大鼠中造成乳腺腺瘤和腺癌,以及在雄性SD大鼠中造成肾腺瘤和甲状腺C细胞腺瘤和癌。有有限证据表明草甘膦在雄性SD鼠中造成肝细胞腺瘤。
小鼠研究
Knezevich and Hogan, (1983)[83]的研究中让CD-1小鼠暴露于饲料中草甘膦(99.8%纯度)两年。50只动物/组/性别在四个暴露组中测试(参看表9)。
这项研究中没有生存差异,也未表明使用的最高剂量超过最大容忍剂量(MTD)。
基于该项研究原本进行的病理学检查,美国环保署(EPA)发现肾小管细胞腺瘤在雄性小鼠中显著增加,表9显示这项分析(p趋势=0.019)。肾小管细胞腺瘤是CD-1小鼠中非常罕见的肿瘤,因此将这样的结果与历史性对照比较很重要。从事Knezevich and Hogan, (1983) 研究的实验室没有这样的历史性对照数据,因此国际癌症研究机构(IARC)、美国环保署(EPA)与EFSA�
